A TRAVÉS DE EL SISTEMA DE NOTIFICACIONES ESPONTÁNEAS:
Se basa en la identificación y detección de las sospechas de reacciones adversas de medicamentos realizadas por profesionales de salud, paciente, ciudadano o persona natural o jurídica.
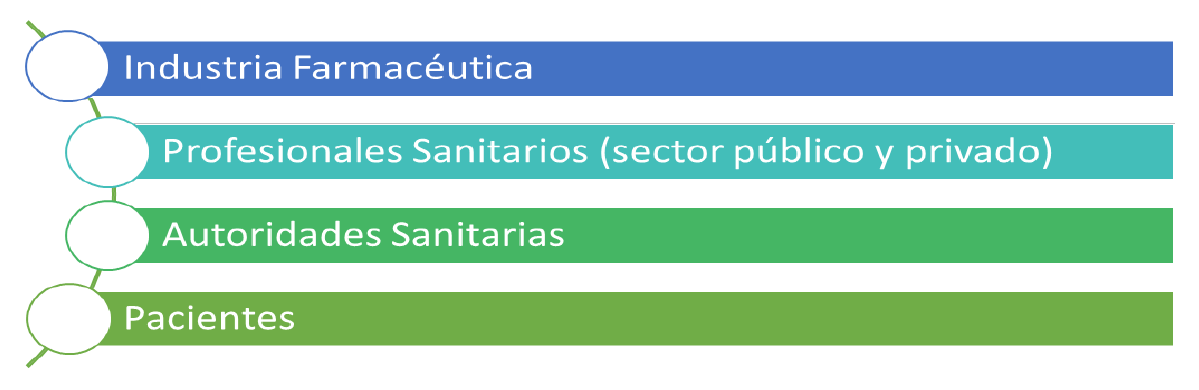
¿Quiénes deben notificar?
Todos los que participan en el desarrollo y la utilización del medicamento:
¿Qué se debe notificar?
Conforme a la Norma Técnica de Farmacovigilancia Art. 26.- Las situaciones a notificar que deben comunicarse al CNFV son las siguientes:
- Casos individuales o series de casos de sospechas de reacciones adversas o reacciones adversas inesperadas o señales.
- Rumores de brotes de eventos leves o conglomerados.
- Brotes de intoxicación por uso de medicamentos.
- Exposiciones en embarazo y lactancia.
- Errores de medicación (errores durante la prescripción, administración, dispensación y errores programáticos).
- Intoxicaciones, sobredosificaciones intencionada o no intencionada e intentos suicidas.
- Usos fuera de indicación (uso off label).
- Falsificados y fraudulentos.
- Fallas terapéuticas de medicamentos y vacunas.
- Todos aquellos eventos con o sin daño al paciente, sospechas de reacciones adversas, reacciones adversas, fallas terapéuticas, errores de medicación o cualquier otro problema relacionado a medicamentos identificados en las investigaciones post-comercialización o estudios postcomercialización.
- Otros problemas relacionados (sospechas y confirmados).
- Alertas y medidas sanitarias que se hayan presentado en otros países de los productos comercializados en El Salvador.
¿Cuándo se debe notificar?
Para el caso de profesionales de salud e instituciones prestadoras de servicios de salud pública y privada: |
|
Para el caso de titulares de registro sanitario, importadores, exportadores, droguerías, distribuidoras, profesionales responsables de registro sanitario, farmacias, botiquines y dispensadores en supermercados, mercados y otros autorizados por la DNM: |
|
¿Cómo se debe notificar?
En El Salvador lo hacemos utilizando los métodos establecidos por el Centro Nacional de Farmacovigilancia, los cuales pueden realizarse utilizando las siguientes herramientas:

